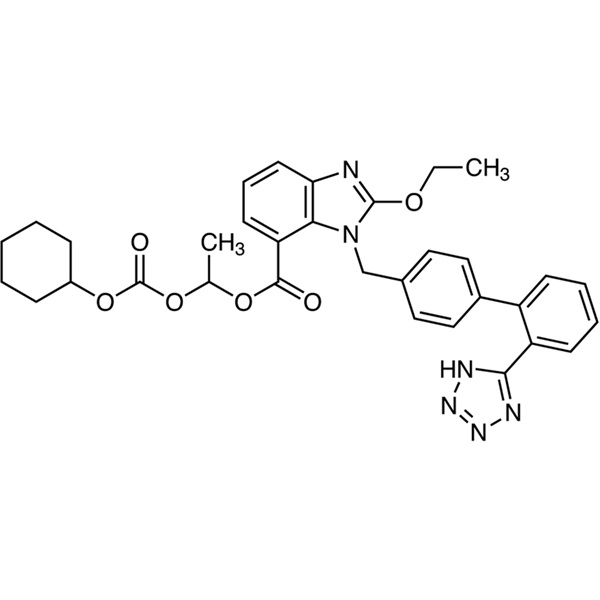
Dosaggio Candesartan Cilexetil CAS 145040-37-5 99,0~101,0% API EP Standard
Ruifu Chemical è il fornitore leader di Candesartan Cilexetil (CAS: 145040-37-5) di alta qualità, in grado di soddisfare lo standard EP. Ruifu fornisce API e intermedi farmaceutici da oltre 15 anni.
Ruifu Chemical può fornire consegne in tutto il mondo, prezzi competitivi e un servizio eccellente.
Acquista Candesartan Cilexetil e i suoi intermedi, contattaci via e-mail: alvin@ruifuchem.com
Ruifu Chemical Supply Candesartan Cilexetil Intermedio con elevata purezza
Candesartan Cilexetil CAS 145040-37-5
Candesartan CAS 139481-59-7
1-Cloroetilcicloesilcarbonato CAS 99464-83-2
Estere etilico intermedio C6 CAS 139481-41-7 di Candesartan Cilexetil
Candesartan Cilexetil Intermedio CAS 139481-44-0
Tritil Candesartan Cilexetil CAS 170791-09-0
| Nome chimico | Candesartan Cilexetil |
| Sinonimi | TCV-116; 1-(((Cicloesilossi)carbonil)ossi)etile 1-((2'-(1H-tetrazolo-5-il)-[1,1'-bifenil]-4-il)metil)-2-etossi-1H-benzo[d]imidazolo-7-carbossilato |
| Numero CAS | 145040-37-5 |
| Stato delle scorte | Disponibile, la produzione scala fino a tonnellate |
| Formula molecolare | C33H34N6O6 |
| Peso Molecolare | 610.66 |
| Densità | 1,37±0,10 g/cm3 |
| Punto di fusione | 168,0-170,0℃ |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Condizioni di conservazione | 2-8℃ |
| Sensibile | Sensibile al calore |
| Origine del prodotto | Shangai, Cina |
| Categorie di prodotti | API (ingrediente farmaceutico attivo) |
| Marchio | Ruifu chimica |
| Articoli | Specifiche | Risultati |
| Aspetto | Polvere bianca o quasi bianca | Polvere bianca |
| Identificazione-IR | Conforme allo spettro di riferimento | Conforme |
| Identificazione- UV | Assorbimenti massimi a 254 nm, assorbimento minimo a 242 nm | Conforme |
| Acqua (KF) | ≤0,30% | 0,19% |
| Solventi residui | ||
| Metanolo | ≤3000 ppm | Non rilevato |
| Etanolo | ≤5000 ppm | Non rilevato |
| Etere etilico | ≤5000 ppm | 62 ppm |
| Acetone | ≤5000 ppm | 505 ppm |
| Acetato di etile | ≤5000 ppm | Non rilevato |
| Diclorometano | ≤600 ppm | Non rilevato |
| Dimetilformammide | ≤880 ppm | Non rilevato |
| Sostanze correlate | ||
| Impurità A | ≤0,15% | 0,04% |
| Impurità B | ≤0,30% | 0,03% |
| Impurità F | ≤0,20% | 0,02% |
| Impurità G | ≤0,20% | 0,04% |
| Impurità H | ≤0,15% | Non rilevato |
| Altre impurità individuali | ≤0,10% | 0,04% |
| Impurità totali | ≤0,60% | 0,23% |
| Cenere solfatata | ≤0,10% | 0,07% |
| Metalli pesanti | ≤10 ppm | <10 ppm |
| Analisi (sostanza secca) | 99,0~101,0% | 99,9% |
| Prova standard | Norma EP | Conforme |
Pacchetto: Bottiglia, sacchetto di alluminio, fusto da 25 kg/cartone o secondo le esigenze del cliente.
Condizioni di conservazione: Tenere il contenitore ben chiuso. Conservare in un magazzino fresco, asciutto (2-8℃) e ben ventilato, lontano da sostanze incompatibili. Tenere lontano dalla luce del sole; evitare fuoco e fonti di calore; evitare l'umidità.
Spedizione: Consegna in tutto il mondo via aerea, via mare, tramite FedEx / DHL Express. Fornire consegne rapide e affidabili.

Codici di rischio
R20/21/22 - Nocivo per inalazione, contatto con la pelle e per ingestione.
R36/37/38 - Irritante per gli occhi, le vie respiratorie e la pelle.
R50- Molto tossico per gli organismi acquatici
R48/20-
R61 - Può causare danni al feto
Descrizione di sicurezza
S26 - In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico.
S36 - Indossare indumenti protettivi idonei.
S61 - Evitare il rilascio nell'ambiente. Fare riferimento alle istruzioni speciali/schede informative in materia di sicurezza.
S45 - In caso di incidente o di malessere consultare immediatamente il medico (mostrare l'etichetta quando possibile).
S53 - Evitare l'esposizione - ottenere istruzioni speciali prima dell'uso.
WGK Germania 3
RTECS DD6672500
Codice HS 2933990099
Candesartan Cilexetil (TCV-116) (CAS: 145040-37-5) è un antagonista del recettore dell'angiotensina II con IC50 di 0,26 nM, utilizzato nel trattamento dell'ipertensione. Candesartan è un bloccante del recettore dell'angiotensina (ARB) che può essere usato da solo o con altri agenti per trattare l'ipertensione. Viene somministrato per via orale come profarmaco, candesartan cilexetil, che viene rapidamente convertito nel suo metabolita attivo, candesartan, durante l'assorbimento nel tratto gastrointestinale. Candesartan abbassa la pressione sanguigna antagonizzando il sistema renina-angiotensina-aldosterone (RAAS); compete con l'angiotensina II per il legame con il sottotipo del recettore dell'angiotensina II tipo-1 (AT1) e previene gli effetti dell'angiotensina II sull'aumento della pressione sanguigna. A differenza degli inibitori dell’enzima di conversione dell’angiotensina (ACE), gli ARB non hanno l’effetto negativo della tosse secca. Candesartan può essere usato per trattare l'ipertensione, l'ipertensione sistolica isolata, l'ipertrofia ventricolare sinistra e la nefropatia diabetica. Può anche essere utilizzato come agente alternativo per il trattamento dell'insufficienza cardiaca, della disfunzione sistolica, dell'infarto del miocardio e della malattia coronarica.
CANDESARTAN CILEXETIL
Candesartan cilexetili
C33H34N6O6 Signor 611
[145040-37-5]
DEFINIZIONE
(1RS)-1-[[(Cicloesilossi)carbonil]ossi]etile
2-etossi-1-[[2′-(1H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato.
Contenuto: dal 99,0 al 101,0% (sostanza anidra).
PRODUZIONE
Poiché le N-nitrosammine sono classificate come probabili cancerogeni per l’uomo, la loro presenza nel candesartan cilexetil deve essere evitata o limitata il più possibile. Per questo motivo, ci si aspetta che i produttori di candesartan cilexetil per uso umano eseguano una valutazione del rischio di formazione e contaminazione di N-nitrosammina durante il processo di produzione; se questa valutazione identifica un rischio potenziale, il processo di produzione deve essere modificato per ridurre al minimo la contaminazione e deve essere implementata una strategia di controllo per rilevare e controllare le impurezze di N-nitrosammina in candesartan cilexetil. Il capitolo generale 2.5.42. Le N-nitrosammine nelle sostanze attive sono disponibili per assistere i produttori.
PERSONAGGI
Aspetto: polvere bianca o quasi bianca.
Solubilità: praticamente insolubile in acqua, facilmente solubile in cloruro di metilene e leggermente solubile in etanolo anidro.
Mostra polimorfismo (5.9).
IDENTIFICAZIONE
Spettrofotometria di assorbimento infrarosso (2.2.24).
Confronto: candesartan cilexetil CRS.
Se gli spettri ottenuti mostrano differenze, sciogliere la sostanza da esaminare e la sostanza di riferimento separatamente in etanolo anidro R, evaporare a secchezza e registrare nuovi spettri utilizzando i residui.
PROVE
Sostanze correlate. Cromatografia liquida (2.2.29). Preparare le soluzioni immediatamente prima dell'uso.
Miscela di solventi: acqua R, acetonitrile R (40:60 V/V).
Soluzione di prova. Sciogliere 20 mg della sostanza da esaminare in 50,0 mL della miscela di solventi.
Soluzione di riferimento (a). Diluire 1,0 mL della soluzione di prova a 100,0 mL con la miscela di solventi. Diluire 1,0 mL di questa soluzione a 10,0 mL con la miscela di solventi.
Soluzione di riferimento (b). Sciogliere 5 mg di candesartan cilexetil per l'idoneità del sistema CRS (contenente impurità A, B e F) nella miscela di solventi e diluire a 10 ml con la miscela di solventi.
Soluzione di riferimento (c). Sciogliere 2,5 mg di candesartan cilexetil per l'identificazione del picco CRS (contenente impurità G e H) nella miscela di solventi e diluire a 5 mL con la miscela di solventi.
Colonna:
- dimensione: l = 0,15 m, Ø = 3,9 mm;
- fase stazionaria: gel di silice ottadecilsilil end-capped per
cromatografia R (4 μm).
Fase mobile:
- fase mobile A: acido acetico glaciale R, acqua per
cromatografia R, acetonitrile R (1:43:57 V/V/V);
- fase mobile B: acido acetico glaciale R, acqua per
cromatografia R, acetonitrile R (1:10:90 V/V/V);
Tempo (min) Fase mobile A (percentuale V/V) Fase mobile B (percentuale V/V)
0- 3 100 0
3- 33 100 → 0 0 → 100
33- 40 0 100
Portata: 0,8 ml/min.
Rilevazione: spettrofotometro a 254 nm.
Iniezione: 10 μL.
Identificazione delle impurità: utilizzare il cromatogramma fornito con candesartan cilexetil per l'idoneità del sistema CRS e il cromatogramma ottenuto con la soluzione di riferimento (b) per identificare i picchi dovuti alle impurezze A, B e F; utilizzare il cromatogramma fornito con candesartan cilexetil per l'identificazione dei picchi CRS e il cromatogramma ottenuto con la soluzione di riferimento (c) per identificare i picchi dovuti alle impurità G e H.
Ritenzione relativa con riferimento a candesartan cilexetil
(tempo di ritenzione = circa 11 min): impurità G = circa 0,2;
impurità A = circa 0,4; impurità B = circa 0,5;
impurità F = circa 2,0; impurità H = circa 3,5.
Idoneità del sistema: soluzione di riferimento (b):
- risoluzione: minimo 4,0 tra i picchi dovuti alle impurità A e B.
Limiti:
- fattori di correzione: per il calcolo del contenuto, moltiplicare le aree dei picchi delle seguenti impurità per il corrispondente fattore di correzione: impurità A e G = 0,7;
impurità H = 1,6;
- impurità B: non più di 3 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,3 per cento);
- impurità F, G: per ciascuna impurezza, non più del doppio dell'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,2 per cento);
- impurità A, H: per ciascuna impurezza, non più di 1,5 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,15 per cento);
- impurezze non specificate: per ciascuna impurezza, non più dell'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,10 per cento);
- totale: non più di 6 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,6 per cento);
- limite di ignorabilità: 0,5 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,05 %).
Acqua (2.5.32): massimo 0,3 %, determinato su 60,0 mg.
Ceneri solfatate (2.4.14): massimo 0,1 %, determinato su 1,0 g.
SAGGIO
Sciogliere 0,500 g in 60 mL di acido acetico glaciale R. Titolare immediatamente con acido perclorico 0,1 M, determinando potenziometricamente il punto finale (2.2.20) al primo punto di flesso.
1 mL di acido perclorico 0,1 M equivale a 61,1 mg di C33H34N6O6.
IMPURITÀ
Impurezze specificate: A, B, F, G, H.
Altre impurezze rilevabili (le seguenti sostanze, se presenti a un livello sufficiente, sarebbero rilevate da uno o dall'altro dei test della monografia. Sono limitate dal criterio generale di accettazione per altre/impurezze non specificate e/o dalla monografia generale Sostanze per uso farmaceutico (2034). Non è quindi necessario identificare queste impurezze per dimostrare la conformità. Vedere anche 5.10. Controllo delle impurezze nelle sostanze per uso farmaceutico): C, D, E, I.
A. etil 2-etossi-1-[[2′-(1H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato,
B. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 2-osso-3-[[2′-(1H-tetrazolo-5-il)bifenil-4-il]metil]-2,3-diidro-1H-benzimidazolo-4-carbossilato,
C. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 3-[[2′-(1-etil-1H-tetrazolo-5-il)bifenil-4-il]metil]-2-osso-2,3-diidro-1H-benzimidazolo-4-carbossilato,
D. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 3-[[2′-(2-etil-2H-tetrazolo-5-il)bifenil-4-il]metil]-2-osso-2,3-diidro-1H-benzimidazolo-4-carbossilato,
E. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 2-etossi-1-[[2′-(1-etil-1H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato,
F. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 2-etossi-1-[[2′-(2-etil-2H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato,
G. 2-etossi-1-[[2′-(1H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-acido carbossilico (candesartan),
H. (1RS)-1-[[(cicloesilossi)carbonil]ossi]etil 2-etossi-1-[[2′-[1-(trifenilmetil)-1H-tetrazolo-5-il]bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato
(N-tritilcandesartan),
I. metil 2-etossi-1-[[2′-(1H-tetrazolo-5-il)bifenil-4-il]metil]-1H-benzimidazolo-7-carbossilato.