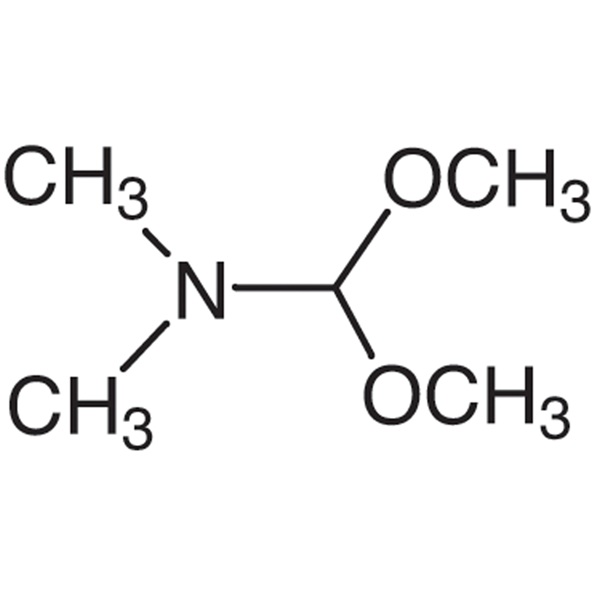
DMF-DMA CAS 4637-24-5 N,N-Dimetilformammide Purezza dimetilacetale >99,0% (GC) Vendita calda in fabbrica
Shanghai Ruifu Chemical è il produttore leader di N,N-Dimetilformammide Dimetil Acetale (DMF-DMA) (CAS: 4637-24-5) di alta qualità. Ruifu può fornire consegne in tutto il mondo, prezzi competitivi, servizio eccellente, quantità piccole e grandi disponibili. Acquista DMF-DMA, Si prega di contattare: alvin@ruifuchem.com
| Nome chimico | N,N-Dimetilformammide Dimetilacetale |
| Sinonimi | DMF-DMA; 1,1-Dimetossitrimetilammina; 1,1-Dimetossi-N,N-Dimetilmetilammina; N-Dimetossimetil-N,N-Dimetilammina |
| Numero CAS | 4637-24-5 |
| Stato delle scorte | Disponibile, la produzione scala fino a tonnellate |
| Formula molecolare | C5H13NO2 |
| Peso Molecolare | 119.16 |
| Punto di ebollizione | 102,0~103,0℃/720 mmHg (lett.) |
| Peso specifico (20/20) | da 0,8940 a 0,8980 |
| Indice di rifrazione n20/D | Da 1,3950 a 1,3980 (lett.) |
| Sensibile | Sensibile all'umidità |
| Solubilità | Miscibile con la maggior parte dei solventi organici |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Marchio | Ruifu chimica |
| Articolo | Specifiche |
| Aspetto | Liquido trasparente incolore |
| Metodo di purezza/analisi | >99,0% (GC) |
| Impurità totali | ≤1,00% |
| Spettro infrarosso | Conforme alla struttura |
| Attenzione | Evitare l'acqua, che può ridurre la purezza del prodotto |
| Prova standard | Standard aziendale |
| Utilizzo | Intermedi farmaceutici |
Pacchetto: Bottiglia, 25 kg/tamburo o secondo le esigenze del cliente.
Condizioni di conservazione: Conservare in un contenitore ermeticamente chiuso. Conservare in un magazzino fresco, asciutto e ben ventilato, lontano da sostanze incompatibili. Proteggere dalla luce e dall'umidità.
Spedizione: Consegna in tutto il mondo via aerea, tramite FedEx / DHL Express. Fornire consegne rapide e affidabili.

Codici di rischio
R11 - Altamente infiammabile
R22- Nocivo se ingerito
R36/37/38 - Irritante per gli occhi, le vie respiratorie e la pelle.
R36/38 - Irritante per gli occhi e la pelle.
R20- Nocivo per inalazione
R20/21/22 - Nocivo per inalazione, contatto con la pelle e per ingestione.
R10- Infiammabile
R52- Nocivo per gli organismi acquatici
Descrizione di sicurezza
S16 - Tenere lontano da fonti di ignizione.
S26 - In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico.
S36/37 - Indossare indumenti e guanti protettivi idonei.
S36/37/39 - Indossare indumenti protettivi adatti, guanti e proteggersi gli occhi/il viso.
S33 - Adottare misure precauzionali contro le scariche statiche.
S29 - Non gettare i residui nelle fognature.
S7/9 -
ID ONU UN 3271 3/PG 2
WGK Germania 1
CODICI FLUKA MARCHIO F 21
TSCA Sì
Classe di pericolo 3
Gruppo di imballaggio II
Tossicità LD50 per via orale nel coniglio: >5000 mg/kg
N,N-Dimetilformammide Dimetil Acetale (DMF-DMA) (CAS: 4637-24-5) ha una vasta gamma di applicazioni, è un importante intermedio nella sintesi di composti eterociclici, è anche un buon reagente metilante e agente disidratante dell'aceto, soprattutto come intermedi di sintesi farmaceutica. DMF - DMA è stato utilizzato nell'esterificazione metilica dell'acido carbossilico. DMF-DMA è utilizzato come intermedio nella formazione di derivati piridinici. DMF-DMA è utilizzato per la derivatizzazione di sulfamidici primari e di acido trifluoroacetico. Viene utilizzato anche nella preparazione dei derivati della formamidina. Viene utilizzato come reagente per n-dimetilamminometilene e esteri metilici. DMF-DMA viene utilizzato per catalizzare l'accoppiamento degli epossidi con l'anidride carbonica per preparare carbonati ciclici. DMF-DMA è un intermedio di Zaleplon (CAS: 151319-34-5).
Da quando Meenvin riportò la preparazione del DMF-DMA (N,N-Dimetilformammide Dimetil Acetale) nel 1956, il DMF-DMA è diventato un reagente spesso utilizzato nella sintesi organica.
DMF - DMA è ampiamente utilizzato nella costruzione di anelli eterociclici a cinque o sei membri nella reazione di chiusura dell'anello. DMF-DMA ha una reazione moderata e un'elevata resa, soprattutto per composti ad alta resistenza.
La struttura generale dei composti ammidici acetalici è la seguente:
I più utilizzati sono DMF-DMA e DMF-DEA, l'ammide acetale si idrolizza facilmente, può essere esterificato, ammidina, reazioni di alchilazione e ciclizzazione.
L'atomo di carbonio centrale di DMF-DMA è collegato a tre eteroatomi con un grande elettronegativo, che gli conferisce una forte attività elettrofila. Sotto l'azione dell'acido, il gruppo alcossi è facile da lasciare e si ottengono ioni positivi con attività elettrofila più forte. La reazione di DMF - DMA consiste principalmente nella reazione di metilazione e nella reazione di formazione.
"One-carbon Syntheson" di DMF-DMA
Nella reazione di chiusura del ciclo che coinvolge DMF-DMA, solo un atomo di carbonio nel prodotto è spesso fornito da DMF-DMA, quindi DMF-DMA può essere considerato un sintetizzatore di carbonio.
Reazione di esterificazione DMF-DMA
L'esterificazione DMF-DMA consente a vari acidi carbossilici di generare facilmente esteri alchilici o arilici C1-20 e i sottoprodotti possono essere facilmente separati mediante distillazione.
L'acido adipico e il DMF-DMA sono stati esterificati a 80 gradi per due ore. L'ammide acetale è la scelta ideale per l'esterificazione di alcuni acidi carbossilici con ostacolo sterico o scarsa stabilità.
Reazione di amidinazione del DMF-DMA e protezione delle ammine primarie
Gli acetali ammidici possono reagire non solo con le ammine primarie, ma anche con ammidi, carbammati, sulfamidici per formare legami idrocarburici.
Come: 2, 4-dimetil anilina e DMF-DMA a 80 gradi possono rimuovere rapidamente il metanolo per formare composti dimetamidinici.
DMF-DMA può anche essere utilizzato come gruppo di protezione dell'ammina primaria, gruppo di protezione dell'ammina primaria (2 N-H tutta la protezione) probabilmente la maggior parte delle persone pensa a ftalile, anello pirrolico, doppio Boc, doppio PMB, ecc., ma la protezione DMF-DMA dell'ammina primaria, in alcuni casi è anche uno schema di protezione molto utile, la protezione disattivata richiede solo una miscela di TFA.
Protezione amminica - 13 introduzione della base di protezione comune, esperienza nella selezione della base di protezione, gamma di utilizzo, condizioni di introduzione, condivisione riepilogativa delle condizioni di rimozione
DMF-DMA reagisce con i gruppi metile e metilene attivi per formare doppi legami carbonio-carbonio
Fenilmetilazione di DMF-DMA
Reazioni di composti eterociclici in DMF-DMA
L'acetale ammidico come singolo donatore di carbonio può essere utilizzato per sintetizzare vari composti complessi e sostanze naturali biomimetiche. Con gli acetali ammidici si possono sintetizzare: 1,2,4 triazolo, 1,2, 4 triazolone, derivati aminoeterociclici, pirimidina, pirimidina, indoli, piridina, chinolina, tiazolo, ossazolone, isoossazolo, 1,2, 4-triazone, piranone, pirazina, pirazina e altre serie di ammoniaca eterociclica derivati, possono anche essere sintetizzati composti eterociclici di ossigeno e zolfo.
In base al tipo di reazione chimica, l'applicazione dell'ammide acetale nella sintesi di composti eterociclici può essere suddivisa nei seguenti tre aspetti.
(1): la reazione lipidica dell'acetale e dell'ammina, dell'ammide, del carbammato, genera una varietà di anelli eterociclici
Reazione amidoacetale e amminica all'intermedio formamidina, quindi reazione dell'anello nucleofilo intramolecolare per generare vari eterocicli, o formamidina e idrazina, idrossilammina, l, 2, uno o due alogenuri alchilici contenenti due gruppi attivi di composti più una lunga catena di carbonio, e quindi anello intramolecolare.
Sintesi di composti eterociclici mediante la reazione di acetali ammidici e ammidi, come la sintesi di derivati l, 2,4 monotriazolici. Innanzitutto, l'acetale reagisce con l'ammide per formare N, N 'tritradil, quindi anelli con fenilidrazina per formare derivati l, 2,4 monotriazolici
Gli acetali ammidici reagiscono con l'acido carbammico o l'acetato per formare anelli eterociclici contenenti cloro. Un intermedio diattivo formato dalla reazione di un'ammide acetale con un amminoetil estere: n.n-dimetil-n 'alchil-carbossimetilformamidina, che reagisce con l'idrazina o l'idrazina sostituita. Ad esempio, per la preparazione dell'1,2,4 triazinone-6, l'equazione è mostrata di seguito. Se lo fai reagire con un nitro-formiato ottieni 1,2,4 triazolone-5.
Meccanismo di reazione per la formazione di 1,2,4 triazolone-5
La composizione di 1.2.4- triazolidina-5 è composto da due passaggi. Innanzitutto, il carbammato di etile e gli acetali diformaldeide DMF formano l'intermedio Nn-dimetil-n-etossi-formamidina. In secondo luogo, il gruppo amminico della fenilidrazina disattacca il carbonio della formamidina, che perde -N (CH3). Quindi l'ammoniaca sull'anello benzenico vicino alla fenilidrazina attacca il carbonio sul gruppo carbonio, formando un anione ossigeno, e la coppia solitaria di elettroni sull'ossigeno scende, perde il gruppo etossilico e produce 1,2,4-triazolone-5.
(II) Preparazione di composti eterociclici mediante la reazione di ammide acetale e ammide
Questo è il metodo di sintesi delle impurità più segnalato negli ultimi decenni. L'azione dell'ammide acetale è equivalente al reagente di Grignard, ma le condizioni di reazione dell'ammide acetale sono semplici e blande.
L'acetale ammidico ha due gruppi attivi, alta reattività e metile attivo, la reazione del metilene per formare intermedi ammidinici, può essere un'ulteriore reazione, la chiusura dell'anello, e il reagente di Grignard e la reazione del metilene, solo allungando la catena del carbonio, non possono essere ulteriori reazioni. Ad esempio, la sintesi dei derivati del furanocroone.
(3): reazione di ammide acetale e idrossile, composto sulfidrilico per generare ossigeno, composti eterociclici di zolfo
La sintesi di furohutanone di cui sopra è un buon esempio della generazione di acetali di derivati enaminici e del gruppo ossidrile mediante separazione del polo endolaterale, con conseguente eterammina contenente ossi-. Un altro esempio: catecolo e DMF -- Il DMA forma anelli contenenti ossigeno in presenza di diclorometano.
La reazione del DMF -- DMA e o-mercaptoanilina possono produrre anelli eterociclici contenenti zolfo-, la formula di reazione è la seguente
Caso di studio della reazione di chiusura dell'anello DMF - DMA e reazione personale
(1) Sintesi dell'indolo Batcho - Leimgruber
Preparazione di vari derivati del Vindol dall'o-nitrotoluene.
Meccanismo di reazione
Innanzitutto, dimetilformammide dimetilacetale, gli ioni negativi del gruppo metossi lasciano produrre un intermedio più reattivo. Viene attaccato dai carboanioni formati dalla deprotonazione dell'idrogeno metilico o-nitrotoluene e perde il metanolo per ottenere la suddetta enilammina. Il prodotto di questa fase, enamina, assomiglia ad un alchene con sostituenti elettron-attrattori ed elettron-donatori attaccati su entrambi i lati (l'olefina push-pull è fortemente polare e spesso rosso scuro a causa dell'ampio intervallo di coniugazione nella molecola. Nella seconda fase della reazione, il gruppo nitro viene ridotto a un gruppo amminico, seguito da ciclizzazione ed eliminazione per ottenere il prodotto finale.
(2) Immagini composite di derivati della piridina
(3) Sintesi di derivati pirazolici