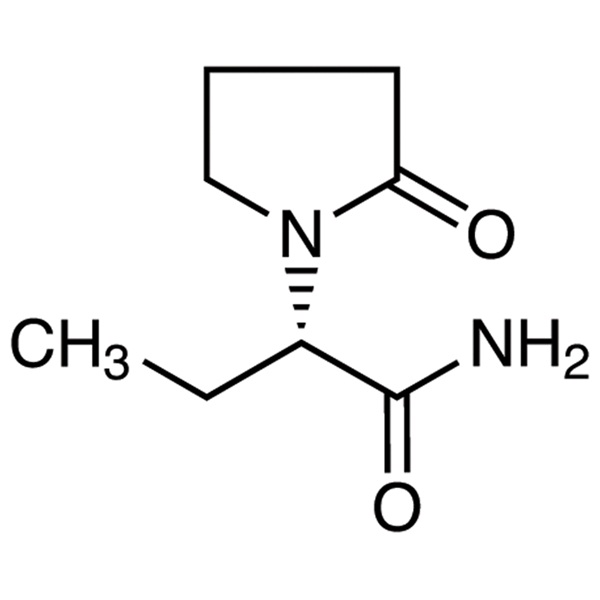
Levetiracetam LEV CAS 102767-28-2 Analisi 98,0%~102,0% Standard USP EP
Shanghai Ruifu Chemical Co., Ltd. è il produttore leader di levetiracetam (CAS: 102767-28-2) di alta qualità e qualità stabile, API, standard USP/EP, farmaco antiepilettico di terza generazione. Ruifu Chemical è in grado di fornire consegne in tutto il mondo, prezzi competitivi, servizio eccellente e disponibilità di piccole quantità e grandi quantità. Acquista Levetiracetam, Si prega di contattare: alvin@ruifuchem.com
| Nome chimico | Levetiracetam |
| Sinonimi | LEV; (S)-2-(2-Oxo-1-pirrolidinil)butirrammide; UCB-L059; (S)-alfa-Etile-2-Oxo-1-Pirrolidineacetammide; (2S)-2-(2-ossopirrolidina-1-il)butanammide |
| Numero CAS | 102767-28-2 |
| Stato delle scorte | Disponibile, capacità produttiva di 500 tonnellate all'anno |
| Formula molecolare | C8H14N2O2 |
| Peso Molecolare | 170.21 |
| Punto di fusione | 116,0~119,0℃ |
| Densità | 1.168 g/cm3 |
| Solubilità | Solubile in acetone |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Origine del prodotto | Shangai, Cina |
| Categorie di prodotti | Antiepilettico; API (ingrediente farmaceutico attivo) |
| Marchio | Ruifu chimica |
| Articolo | Specifiche |
| Aspetto | Polvere di cristalli bianchi o quasi bianchi |
| Identificazione | IR |
| Aspetto della soluzione | Chiaro e non più intensamente colorato di BY6 |
| Limite di Levetiracetam R-Enantiomero | ≤0,80% |
| Acqua (di KF) | ≤0,50% |
| Residuo all'accensione | ≤0,10% |
| Metalli pesanti | ≤0,001% |
| Sostanze correlate | |
| Piridina-2-ol | ≤0,025% |
| Acido levetiracetam | ≤0,30% |
| Composto correlato al levetiracetam A | ≤0,05% |
| Composto correlato al levetiracetam B | ≤0,10% |
| Qualsiasi impurità individuale non specificata | ≤0,05% |
| Impurità totali non specificate | ≤0,10% |
| Impurità totali | ≤0,40% |
| Solventi residui | Soddisfa le specifiche |
| Metodo di dosaggio/analisi | 98,0%~102,0% (calcolato su base anidra e priva di solventi) |
| Prova standard | Norma USP; Norma EP |
| Applicazione | API; Farmaco antiepilettico di terza generazione |
Pacchetto: Bottiglia, sacchetto di foglio di alluminio, fusto di cartone da 25 kg, o secondo le esigenze del cliente.
Condizioni di conservazione: Tenere il contenitore ben chiuso e conservarlo in un magazzino fresco, asciutto e ben ventilato, lontano da sostanze incompatibili. Tenere lontano dalla luce del sole; evitare fuoco e fonti di calore; evitare l'umidità.
Spedizione: Consegna in tutto il mondo via aerea, tramite FedEx/DHL Express. Fornire consegne rapide e affidabili.
Levetiracetam
C8H14N2O2 170,21
1-Pirrolidineacetammide, -etil-2-osso-, (S)-;
()-(S)--Etil-2-osso-1-pirrolidineacetammide [102767-28-2].
DEFINIZIONE
Levetiracetam contiene NLT 98,0% e NMT 102,0% di C8H14N2O2, calcolato su base anidra e priva di solventi.
IDENTIFICAZIONE
• A. Assorbimento degli infrarossi<197K>
• B. Il tempo di ritenzione del picco principale del levetiracetam dalla soluzione campione corrisponde a quello del levetiracetam S-enantiomero dalla soluzione di idoneità del sistema, come ottenuto nel test per il limite di levetiracetam R-enantiomero.
SAGGIO
• Procedura
Tampone: 2,7 g/L di fosfato di potassio monobasico in acqua. Regolare con idrossido di potassio acquoso al 2% (p/v) fino a un pH di 5,5.
Soluzione A: acetonitrile e tampone (1:19)
Soluzione B: acetonitrile
Fase mobile: vedere la tabella dei gradienti di seguito.
Tempo (min) Soluzione A (%) Soluzione B (%)
0 100 0
3 100 0
20 71 29
Soluzione di idoneità del sistema: 0,2 mg/ml di USP Levetiracetam RS e 0,08 mg/ml di USP Levetiracetam Related Compound A RS nella soluzione A. Prepararsi sciogliendo prima la quantità richiesta di USP Levetiracetam RS in un matraccio tarato adatto. Aggiungere il 10% del volume del pallone di idrossido di potassio 0,1 N. Lasciare reagire la miscela a temperatura ambiente per circa 15 minuti, quindi neutralizzare aggiungendo acido cloridrico 0,1 N al 10% del volume del pallone. Aggiungere la quantità necessaria di composto A RS correlato al levetiracetam USP, sonicare per dissolverlo, diluire con la soluzione A a volume e mescolare.
Soluzione standard: 0,1 mg/ml di Levetiracetam RS USP nella soluzione A
Soluzione campione: 0,1 mg/mL di Levetiracetam nella Soluzione A
Sistema cromatografico
(Vedere Cromatografia<621>, Idoneità del sistema.)
Modalità:LC
Rivelatore: UV 205 nm
Colonna: 4,6-mm × 15-cm; imballaggio L1
Portata: 0,9 ml/min
Dimensione dell'iniezione: 10 µl
Idoneità del sistema
Esempio: soluzione di idoneità del sistema
[Nota-I tempi di ritenzione relativi sono riportati nella Tabella delle impurità 1.]
Requisiti di idoneità
Deviazione standard relativa: NMT 1,0%
[Nota-Se non è possibile soddisfare i criteri di idoneità del sistema, si consiglia di mantenere la temperatura della colonna a 20 per stabilizzare il sistema.]
Analisi
Campioni: soluzione standard e soluzione campione
Calcolare la percentuale di C8H14N2O2 nella porzione di Levetiracetam assunta:
Risultato = [(rU/rS) × (CS/CU) × 100] F
rU = risposta di picco del levetiracetam dalla soluzione campione
rS = risposta di picco del levetiracetam dalla soluzione standard
CS = concentrazione di USP Levetiracetam RS nella soluzione standard (mg/mL)
CU = concentrazione di Levetiracetam nella soluzione campione (mg/mL)
F = percentuale di levetiracetam R-enantiomero dal test per il Limite di Levetiracetam R-Enantiomero
Criteri di accettazione: 98,0%-102,0% su base anidra e senza solventi-
IMPURITÀ
Impurezze inorganiche
• Residuo all'accensione<281>: NMT 0,1%
• Metalli pesanti, Metodo II<231>: 20 ppm
Impurità organiche
• Procedura 1: Limite del composto correlato al levetiracetam B
[Nota-Eseguire questo test solo se il composto B correlato al levetiracetam è un'impurità di processo nota.]
Tampone: 1,22 g di 1-decansolfonato di sodio in 1 L di acqua contenente circa 1,3 mL di acido fosforico. Regolare con idrossido di potassio al 20% (p/v) fino a un pH di 3,0.
Fase mobile: acetonitrile e tampone (3:17)
Soluzione di idoneità del sistema: 2 mg/ml di composto B RS correlato al levetiracetam USP in fase mobile
Soluzione standard: 0,002 mg/ml di composto B RS correlato al levetiracetam USP in fase mobile
Soluzione campione: 2,0 mg/mL di Levetiracetam in fase mobile
Sistema cromatografico
(Vedere Cromatografia 621, Idoneità del sistema.)
Modalità:LC
Rivelatore: UV 200 nm
Colonna: 4,6-mm × 25-cm; imballaggio L1
Velocità di flusso: 1,0 ml/min
Dimensione dell'iniezione
Idoneità del sistema: 10 µL
Analisi: 50 µl
Idoneità del sistema
Esempio: soluzione di idoneità del sistema
[Nota-Il tempo di ritenzione per il composto B correlato al levetiracetam è di 9 minuti.]
Requisiti di idoneità
Fattore di scodamento: NMT 3.0
[Nota-Se si osserva uno scodamento significativo del picco del composto B correlato al levetiracetam (maggiore di 3,0), si consiglia di mantenere la temperatura della colonna a 27 per stabilizzare il sistema.]
Deviazione standard relativa: NMT 2,0%
Analisi
Campioni: soluzione standard e soluzione campione
Calcolare la percentuale del composto B correlato al levetiracetam nella porzione di Levetiracetam assunta:
Risultato = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = risposta di picco del composto B correlato al levetiracetam dalla soluzione campione
rS = risposta di picco del composto B correlato al levetiracetam dalla soluzione standard
CS = concentrazione del composto B RS correlato al levetiracetam USP nella soluzione standard (mg/ml)
CU = concentrazione di Levetiracetam nella soluzione campione (mg/mL)
Mr1 = peso molecolare della base libera del composto B correlato al levetiracetam, 102,1
Mr2 = peso molecolare del composto B correlato al levetiracetam, 138,6
Criteri di accettazione: NMT 0,10%
[Nota-La quantità di composto B correlato al levetiracetam misurata deve essere inclusa nelle impurità totali nel test per le impurità organiche, Procedura 2.]
• Procedura 2
Tampone, soluzione A, soluzione B, fase mobile, soluzione di idoneità del sistema e sistema cromatografico: procedere come indicato nel dosaggio.
Soluzione standard: 0,005 mg/ml di Levetiracetam RS USP nella Soluzione A
Soluzione campione: 5 mg/mL di Levetiracetam nella Soluzione A
Analisi
Campioni: soluzione standard e soluzione campione
Calcolare la percentuale di ciascuna impurità presente nella porzione di Levetiracetam assunta:
Risultato = (rU/rS) × (CS/CU) × (1/F) × 100
rU = risposta di picco di ciascuna impurità dalla soluzione campione
rS = risposta di picco del levetiracetam dalla soluzione standard
CS = concentrazione di USP Levetiracetam RS nella soluzione standard (mg/mL)
CU = concentrazione di Levetiracetam nella soluzione campione (mg/mL)
F = fattore di risposta relativo (vedere Tabella delle impurità 1)
[Nota-Ignorare qualsiasi picco con un tempo di ritenzione relativo pari o inferiore a 0,19.]
Criteri di accettazione
Impurezze individuali: vedere la tabella delle impurezze 1.
Impurezze totali: NMT 0,4%
Impurezza Tabella 1
Nome Tempo di ritenzione relativo Fattore di risposta relativo Criteri di accettazione, NMT (%)
Piridina-2-olo a 0,37 1,0 0,025
Levetiracetam acidob 0,62 1,2 0,3
Levetiracetam 1,00 - -
Composto correlato al levetiracetam Ac 1,25 0,35 0,05
Qualsiasi impurità individuale non specificata - 1,0 0,05
a Non incluso nel limite delle impurità totali.
b acido (S)-2-(2-ossopirrolidin-1-il)butanoico. Incluso nel limite delle impurità totali.
c (S)-N-(1-ammino-1-ossobutan-2-il)-4-clorobutanammide. Incluso nel limite delle impurezze totali solo se il composto B correlato al levetiracetam è un'impurezza di processo nota.
TEST SPECIFICI
• Determinazione dell'acqua, metodo Ia<921>: NMT 0,5%
• Limite di Levetiracetam R-Enantiomero
Fase mobile: n-Esano e alcol disidratato (4:1)
Soluzione di idoneità del sistema: 0,1 mg/mL di miscela racemica USP Levetiracetam RS in fase mobile
Soluzione standard: 0,05 mg/mL di USP Levetiracetam RS in fase mobile
Soluzione campione: 10 mg/mL di Levetiracetam in fase Mobile
Sistema cromatografico
(Vedere Cromatografia<621>, Idoneità del sistema.)
Modalità:LC
Rivelatore: UV 215 nm
Colonna: 4,6-mm × 25-cm; Confezione da 10-μm L51
Velocità di flusso: 1,0 ml/min
Dimensione dell'iniezione: 20 µl
Idoneità del sistema
Esempio: soluzione di idoneità del sistema
[Nota-I tempi di ritenzione relativi per levetiracetam R-enantiomer e levetiracetam S-enantiomer sono rispettivamente 0,55 e 1,0.]
Requisiti di idoneità
Risoluzione: NLT 4.0 tra R- e S-enantiomeri
[Nota-Se si osserva una perdita di risoluzione (inferiore a 4,0), si consiglia di mantenere la temperatura della colonna a 25 per stabilizzare il sistema.]
Analisi
Campioni: soluzione standard e soluzione campione
Calcolare la percentuale di levetiracetam R-enantiomero nella porzione di Levetiracetam assunta:
Risultato = (rU/rS) × (CS/CU) × 100
rU = risposta di picco dell'enantiomero levetiracetam R-dalla soluzione campione
rS = risposta di picco del levetiracetam dalla soluzione standard
CS = concentrazione di USP Levetiracetam RS nella soluzione standard (mg/mL)
CU = concentrazione di Levetiracetam nella soluzione campione (mg/mL)
Criteri di accettazione: NMT 0,8%
REQUISITI AGGIUNTIVI
• Imballaggio e conservazione: conservare in contenitori ben chiusi e conservare a temperatura ambiente.
• Standard di riferimento USP<11>
USP Levetiracetam RS
Miscela racemica USP Levetiracetam RS
Una miscela 1:1 di levetiracetam S-enatiomero-(2S)-2-(2-ossopirrolidina-1-il)butanammide e levetiracetam R-enantiomero (2R)-2-(2-ossopirrolidina-1-il)butanammide.
Composto A RS correlato al levetiracetam USP
(S)-N-(1-ammino-1-ossobutan-2-il)-4-clorobutanammide.
C8H14ClNO3 207,65
Composto B RS correlato al levetiracetam USP
(S)-2-Amminobutanammide cloridrato.
C4H10N2O·HCl 138,6

Il levetiracetam (CAS: 102767-28-2), un derivato del pilacetam, è un nuovo farmaco antiepilettico di terza generazione approvato dalla FDA statunitense nel 1999. Inizialmente veniva utilizzato per il trattamento aggiuntivo delle crisi parziali negli adulti. Nel 2005, il levetiracetam è stato approvato in compresse e soluzioni orali per il trattamento aggiuntivo delle crisi parziali nei bambini di età pari o superiore a 4 anni. Viene utilizzato principalmente per il trattamento additivo delle crisi parziali negli adulti e nei bambini di età superiore ai 4 anni e può essere utilizzato anche solo per le crisi parziali e sistemiche negli adulti. Ha anche un certo effetto curativo sull'epilessia mioclonica negli adolescenti, sull'epilessia refrattaria, sull'epilessia assente nei bambini e sull'epilessia persistente.