Telmisartan CAS 144701-48-4 Analisi 99,0%~101,0% API EP Standard Alta qualità
Shanghai Ruifu Chemical Co., Ltd. è il fornitore leader di Telmisartan (CAS: 144701-48-4) di alta qualità, in grado di soddisfare gli standard USP/EP. DMF/CEP/GMP disponibili.
Ruifu Chemical fornisce API e intermedi farmaceutici da oltre 15 anni.
Ruifu Chemical può fornire consegne in tutto il mondo, prezzi competitivi e un servizio eccellente.
Acquista Telmisartan e relativi intermedi, contattaci via e-mail:alvin@ruifuchem.com
| Nome chimico | Telmisartan |
| Sinonimi | 4'-[[4-Metile-6-(1-Metile-1H-Benzimidazolo-2-ile)-2-Propile-1H-Benzimidazolo-1-il]metil]bifenil-2-Acido carbossilico; 4'-[(1,4'-Dimetil-2'-propil[2,6'-bi-1H-Benzimidazolo]-1'-il)metil]-[1,1'-Bifenil]-2-Acido carbossilico |
| Numero CAS | 144701-48-4 |
| Stato delle scorte | Disponibile, la produzione scala fino a tonnellate |
| Formula molecolare | C33H30N4O2 |
| Peso Molecolare | 514.63 |
| Punto di fusione | 261,0~263,0℃ |
| Solubilità in acqua | Insolubile |
| Stabilità | Igroscopico |
| Condizioni di conservazione | 2-8℃ |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Origine del prodotto | Shangai, Cina |
| Categorie di prodotti | API (ingrediente farmaceutico attivo) |
| Marchio | Ruifu chimica |
| Articoli | Specifiche | Risultati |
| Aspetto | Polvere cristallina bianca o leggermente giallastra | Polvere cristallina bianca |
| Solubilità | Dovrebbe soddisfare i requisiti | Conforme |
| Identificazione IR | Dovrebbe corrispondere all'assorbimento degli infrarossi RS | Conforme |
| Aspetto della soluzione | Dovrebbe soddisfare i requisiti | Conforme |
| Sostanze correlate | ||
| Impurità A | ≤0,15% | 0,05% |
| Impurità B | ≤0,15% | 0,02% |
| Impurità C | ≤0,20% | 0,03% |
| Impurità D | ≤0,20% | 0,05% |
| Impurità non specificate: | ≤0,10% | 0,06% |
| Impurità totali | ≤1,00% | 0,30% |
| Solventi residui | ||
| Metanolo | ≤0,30% | Non rilevato |
| Etanolo | ≤0,50% | 0,031% |
| Cloruro di metilene | ≤0,06% | Non rilevato |
| n-Esano | ≤0,029% | Non rilevato |
| Estere etilico dell'acido acetico | ≤0,50% | Non rilevato |
| Toluene | ≤0,089% | 0,025% |
| Acido acetico | ≤0,50% | 0,036% |
| Perdita all'essiccazione | ≤0,50% | 0,20% |
| Ceneri Solfatate | ≤0,10% | Conforme |
| Punto di fusione | 261,0~263,0℃ | 261,5~262,1℃ |
| Dimensione delle particelle | 90% Inferiore a 200μm | Conforme |
| Analisi | 99,0%~101,0% (Sostanza essiccata) | 99,9% |
| Prova standard | Conforme alla Farmacopea Europea 7.0 | Conforme |
Pacchetto: Bottiglia, sacchetto di alluminio, fusto da 25 kg/cartone o secondo le esigenze del cliente.
Condizioni di conservazione: Tenere il contenitore ben chiuso. Conservare in un magazzino fresco, asciutto (2-8℃) e ben ventilato, lontano da sostanze incompatibili. Tenere lontano dalla luce del sole; evitare fuoco e fonti di calore; evitare l'umidità.
Spedizione: Consegna in tutto il mondo via aerea, via mare, tramite FedEx / DHL Express. Fornire consegne rapide e affidabili.

Simboli di pericolo Xi - Irritante
Codici di rischio 36/37/38 - Irritante per gli occhi, le vie respiratorie e la pelle.
Descrizione di sicurezza S22 - Non respirare la polvere.
S24/25 - Evitare il contatto con la pelle e gli occhi.
S36 - Indossare indumenti protettivi idonei.
S26 - In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico.
WGK Germania 2
RTECS DV2037500
Codice HS 2933990099
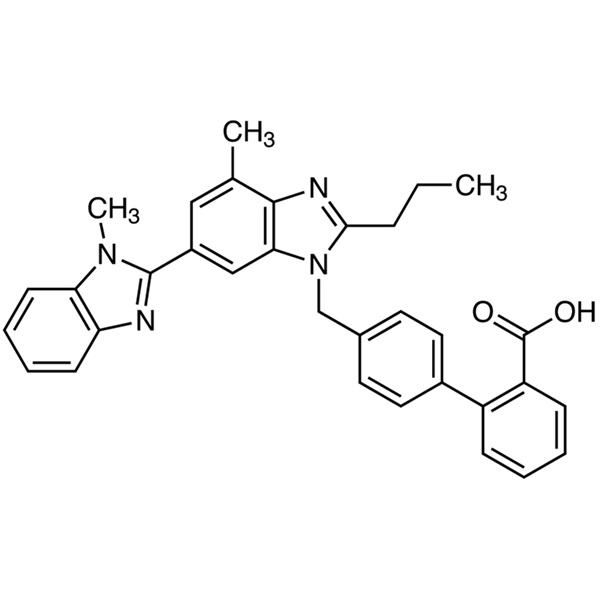
Telmisartan (CAS: 144701-48-4) è un derivato del benzimidazolo e un antagonista non-peptidico del recettore dell'angiotensina II con proprietà antipertensiva. Telmisartan antagonizza selettivamente il legame dell’angiotensina II con il recettore del sottotipo AT1, situato nella muscolatura liscia vascolare e nella ghiandola surrenale. L'antagonismo provoca vasodilatazione e inibisce la produzione di aldosterone mediata dall'angiotensina II, che a sua volta porta ad una diminuzione di sodio e acqua nonché ad un aumento dell'escrezione di potassio con conseguente riduzione della pressione sanguigna. Il telmisartan è un nuovo tipo di farmaci per la pressione del sangue, viene utilizzato da solo o in combinazione con altre classi di antipertensivi per il trattamento dell'ipertensione. Telmisartan è stato originariamente formulato dalla società farmaceutica tedesca Boehringer Ingelheim; ha ottenuto il brevetto tedesco EP502,314 nel 1991, è stato approvato per la prima volta per entrare nel mercato americano nel novembre 1998, quindi è entrato nei mercati tedesco, filippino, australiano, belga, britannico e in altri mercati.
C33H30N4O2
Signor 514.6
[144701-48-4]
DEFINIZIONE
acido 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-acido carbossilico.
Contenuto: dal 99,0% al 101,0% (sostanza essiccata).
PERSONAGGI
Aspetto: polvere cristallina bianca o leggermente giallastra.
Solubilità: praticamente insolubile in acqua, leggermente solubile in metanolo, scarsamente solubile in cloruro di metilene. Si dissolve in una soluzione da 40 g/l di idrossido di sodio R.
Mostra polimorfismo (5.9).
IDENTIFICAZIONE
Spettrofotometria di assorbimento infrarosso (2.2.24).
Confronto: Telmisartan CRS.
Se gli spettri ottenuti allo stato solido mostrano differenze, sciogliere la sostanza da esaminare e la sostanza di riferimento separatamente in etanolo anidro caldo R, evaporare a secchezza e registrare nuovi spettri utilizzando i residui.
PROVE
Aspetto della soluzione. La soluzione non è colorata più intensamente della soluzione di riferimento Y4 (2.2.2, Metodo II).
Sciogliere 0,5 g in una soluzione da 40 g/L di idrossido di sodio R e diluire a 10 mL con lo stesso solvente.
Sostanze correlate. Cromatografia liquida (2.2.29).
Soluzione di prova. A 25 mg della sostanza da esaminare aggiungere circa 5 mL di metanolo R e 100 μL di una soluzione da 40 g/L di idrossido di sodio R. Sciogliere mediante sonicazione e diluire a 50,0 mL con metanolo R.
Soluzione di riferimento (a). Diluire 1,0 mL della soluzione di prova a 10,0 mL con metanolo R. Diluire 1,0 mL di questa soluzione a 100,0 mL con metanolo R.
Soluzione di riferimento (b). Sciogliere il contenuto di una fiala di telmisartan per l'idoneità del sistema CRS (contenente impurità A, B, C, E ed F) in 2 ml di metanolo R.
Soluzione di riferimento (c). A 5 mg di telmisartan per l'identificazione del picco CRS (contenente impurità D) aggiungere circa 5 ml di metanolo R e 100 μl di una soluzione da 40 g/l di idrossido di sodio R. Sciogliere mediante sonicazione e diluire a 10 ml con metanolo R.
Colonna:
– dimensione: l = 0,125 m, Ø = 4,0 mm;
– fase stazionaria: gel di silice ottadecilsilil end-capped per cromatografia R (5 μm) con una dimensione dei pori di 10 nm;
– temperatura: 40 °C.
Fase mobile:
– fase mobile A: sciogliere 2,0 g di potassio diidrogeno fosfato R e 3,8 g di sodio pentansolfonato monoidrato R1 in 900 mL di acqua per cromatografia R, regolare a pH 3,0 con acido fosforico diluito R e diluire a
1000 mL con acqua per cromatografia R;
– fase mobile B: metanolo R1, acetonitrile per cromatografia R (20:80 V/V);
Tempo (min) Fase mobile A (percentuale V/V) Fase mobile B (percentuale V/V)
0- 3 70 30
3- 28 70 → 20 30 → 80
Portata: 1 ml/min.
Rilevazione: spettrofotometro a 230 nm.
Iniezione: 10 μL.
Identificazione delle impurezze: utilizzare il cromatogramma fornito con telmisartan per l'idoneità del sistema CRS e il cromatogramma ottenuto con la soluzione di riferimento (b) per identificare i picchi dovuti alle impurezze A, B, C, E ed F;
utilizzare il cromatogramma fornito con telmisartan per l'identificazione del picco CRS e il cromatogramma ottenuto con la soluzione di riferimento (c) per identificare il picco dovuto all'impurezza D.
Ritenzione relativa con riferimento al telmisartan
(tempo di ritenzione = circa 15 min): impurità A = circa 0,2;
impurità E = circa 0,6; impurità F = circa 0,7;
impurità B = circa 0,9; impurità C = circa 1,5;
impurità D = circa 1,6.
Idoneità del sistema: soluzione di riferimento (b):
– il cromatogramma ottenuto con la soluzione di riferimento (b) è simile al cromatogramma fornito con telmisartan per l'idoneità del sistema CRS;
– risoluzione: minimo 3,0 tra i picchi dovuti all'impurezza B e al telmisartan.
Limiti:
– impurità C, D: per ciascuna impurezza, non più del doppio dell'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,2 per cento);
– impurità A, B: per ciascuna impurezza, non più di 1,5 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,15 per cento);
– impurezze non specificate: per ciascuna impurezza, non più dell'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,10 per cento);
– totale: non più di 10 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (1,0 per cento);
– limite di ignorabilità: 0,5 volte l'area del picco principale nel cromatogramma ottenuto con la soluzione di riferimento (a) (0,05 %).
Perdita all'essiccazione (2.2.32): massimo 0,5 %, determinato su 1.000 g mediante essiccazione in forno a 105 ℃.
Ceneri solfatate (2.4.14): massimo 0,1 %, determinato su 1,0 g.
SAGGIO
Sciogliere 0,190 g in 5 mL di acido formico anidro R. Aggiungere 75 mL di anidride acetica R. Titolare con acido perclorico 0,1 M, determinando il punto finale potenziometricamente (2.2.20).
1 mL di acido perclorico 0,1 M equivale a 25,73 mg di C33H30N4O2.
IMPURITÀ
Impurezze specificate: A, B, C, D.
Altre impurezze rilevabili (le seguenti sostanze, se presenti a un livello sufficiente, sarebbero rilevate da uno o dall'altro dei test della monografia. Sono limitate dal criterio generale di accettazione per altre impurezze/non specificate e/o dalla monografia generale Sostanze per uso farmaceutico (2034). Non è quindi necessario identificare queste impurezze per dimostrare la conformità. Vedere anche 5.10. Controllo delle impurezze nelle sostanze per uso farmaceutico): E, F, G, H, Io, J.
A. 4-metil-6-(1-metil-1H-benzimidazolo-2-il)-2-propil-1H-benzimidazolo,
B. acido 4′-[[7-metil-5-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-acido carbossilico,
C. tert-butile 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carbossilato,
D. struttura sconosciuta,
E. acido 1-[(2′-carbossi[1,1′-bifenil]-4-il)metil]-4-metil-2-propil-1H-benzimidazolo-6-acido carbossilico,
F. 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carbossammide,
G. 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carbonitrile,
H. tert-butil 4′-(bromometil)[1,1′-bifenil]-2-carbossilato,
I. metil 4′-[(1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibenzimidazol]-3′-il)metil][1,1′-bifenil]-2-carbossilato,
J. Acido 4′-[(5-cloro-1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibenzimidazol]-3′-il)metil][1,1′-bifenil]-2-acido carbossilico.