Valsartan CAS 137862-53-4 Analisi 98,0~102,0% API USP Standard
Ruifu Chemical è il fornitore leader di Valsartan (CAS: 137862-53-4) di alta qualità, in grado di soddisfare gli standard USP/EP. Ruifu Chemical fornisce API e intermedi farmaceutici da oltre 15 anni.
Ruifu Chemical può fornire consegne in tutto il mondo, prezzi competitivi e un servizio eccellente.
Acquistare Valsartan e relativi intermedi, contattaci via e-mail: alvin@ruifuchem.com
| Nome chimico | Valsartan |
| Sinonimi | N-Valeril-N-[2'-(1H-tetrazolo-5-il)bifenil-4-ilmetil]-L-valina |
| Numero CAS | 137862-53-4 |
| Stato delle scorte | Disponibile, la produzione scala fino a tonnellate |
| Formula molecolare | C24H29N5O3 |
| Peso Molecolare | 435,52 |
| Punto di fusione | 116,0~117,0℃ |
| Densità | 1,212±0,06 g/cm3 |
| Stabilità | Igroscopico |
| Solubilità | Solubile in metanolo |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Origine | Shangai, Cina |
| Categorie di prodotti | API (ingrediente farmaceutico attivo) |
| Marchio | Ruifu chimica |
| Articoli di prova | Specifiche | Risultati |
| Aspetto | Polvere cristallina da bianca a quasi bianca | Polvere cristallina bianca |
| Identificazione | ||
| IR | Deve essere conforme alla norma di riferimento | Conforme |
| HPLC | Deve essere conforme alla norma di riferimento | Conforme |
| Assorbenza (420 mm) | ≤0,02% (λ=420 nm, C=0,05 g/ml, L=1 cm) | 0,012% |
| Acqua (di KF) | ≤1,00% | 0,20% |
| Residuo all'accensione | ≤0,10% | 0,06% |
| Metalli pesanti | ≤0,001% | <0,001% |
| Sostanze correlate | ||
| Composto A | ≤1,00% | 0,37% |
| Composto B | ≤0,20% | 0,02% |
| Composto C | ≤0,10% | Non rilevabile |
| Qualsiasi altra impurità individuale | ≤0,10% | 0,02% |
| Impurità totali | ≤0,30% (escluso R-isomero) | 0,07% |
| Solventi residui (GC) | ||
| Metanolo | ≤3000 ppm | 693 ppm |
| Acetato di etile | ≤5000 ppm | 3013 ppm |
| N,N-Dimetilformammide | ≤880 ppm | Non rilevabile |
| Toluene | ≤890 ppm | 8 ppm |
| Metodo di dosaggio/analisi | 98,0~102,0% (calcolato sull'anidro Base, Solvente-Base libera) | 99,7% |
| Prova standard | USP37 | Conforme |
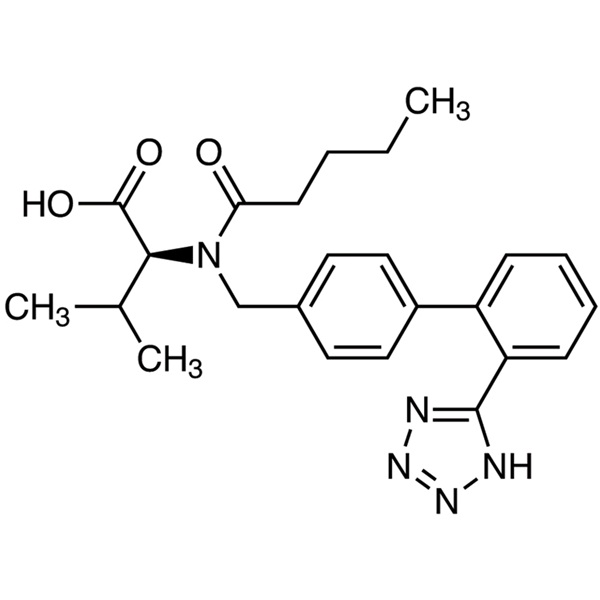
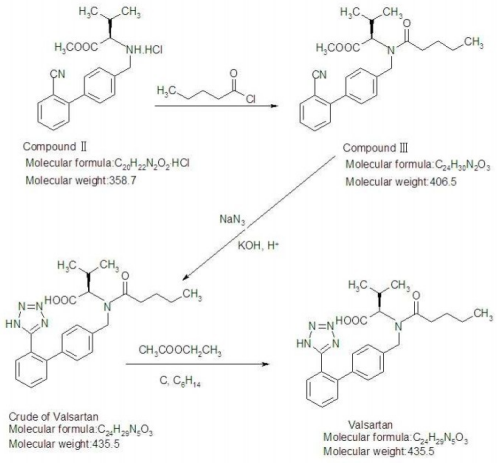
Valsartan
C24H29N5O3 435,52
l-Valina, N-(1-ossopentil)-N-[[2'-(1H-tetrazolo-5-il)[1,1'-bifenil]-4-il]metil]-.
N-[p-(o-1H-Tetrazolo-5-ilfenil)benzile]-N-valeril-l-valina [137862-53-4].
Valsartan contiene non meno del 98,0% e non più del 102,0% di C24H29N5O3, calcolato su base anidra.
Imballaggio e stoccaggio-Conservare in contenitori stretti e conservare a 25, escursioni consentite tra 15 e 30. Proteggere dall'umidità e dal calore.
Norme di riferimento USP<11>-
USP Valsartan RS
Composto A RS correlato al valsartan USP
(R-N-Valeril-N-([2'-(1H-tetrazolo-5-il)bifen-4-il]metil)valina.
C24H29N5O3 435,52
Composto B RS correlato al valsartan USP
(S-N-Butirril-N-([2'-(1H-tetrazolo-5-il)bifen-4-il]metil)-valina.
C23H27N5O3 421,49
Composto C RS correlato al valsartan USP
(S-N-Valeril-N-([2'-(1H-tetrazolo-5-il)bifen-4-il]metil)-valina benzil estere.
C31H35N5O3 525,64
Identificazione-
A: Assorbimento degli infrarossi <197M>.
B: Il tempo di ritenzione del picco maggiore nel cromatogramma della preparazione del test corrisponde a quello nel cromatogramma della preparazione dello standard, come ottenuto nel test.
Assorbanza-Preparare una soluzione 1 a 20 in metanolo e determinare l'assorbanza a 420 nm. L'assorbanza divisa per la lunghezza del percorso non è superiore a 0,02.
Acqua, Metodo I<921>: non più del 2,0%.
Residuo alla combustione<281>: non più dello 0,1%.
Metalli pesanti, Metodo II<231>: 0,001%.
Composti correlati-
test 1 (limite del composto a) correlato a valsartan -
Fase mobile-Preparare una miscela di n-esano, 2-propanolo e acido trifluoroacetico (85:15:0,1). Se necessario, apportare le modifiche (vedere Idoneità del sistema in Cromatografia 621).
Soluzione standard - Sciogliere una quantità accuratamente pesata di composto A RS correlato al valsartan USP nella fase mobile e diluire quantitativamente, e gradualmente se necessario, per ottenere una soluzione avente una concentrazione nota di circa 0,01 mg per mL.
Soluzione di idoneità del sistema - Sciogliere quantità accuratamente pesate di USP Valsartan RS e USP Valsartan Related Compound A RS nella fase mobile per ottenere una soluzione avente concentrazioni note di circa 0,04 mg per ml ciascuna di valsartan e composto correlato a valsartan A.
Soluzione test-Trasferire circa 50 mg di Valsartan, accuratamente pesati, in un matraccio tarato da 50-mL, aggiungere circa 40 mL di fase mobile e sonicare per 5 minuti. Diluire con la fase mobile a volume e mescolare.
Sistema cromatografico (vedi Cromatografia<621>)-Il cromatografo liquido è dotato di un rilevatore da 230-nm e di una colonna da 4,6-mm × 25-cm che contiene un impaccamento L40 da 5-μm. La portata è di circa 0,8 ml al minuto. Cromatografare la soluzione di idoneità del sistema e registrare le risposte dei picchi come indicato nella Procedura: la risoluzione, R, tra il composto A correlato a valsartan e valsartan non è inferiore a 2,0; e la deviazione standard relativa, determinata dal picco del composto A correlato a valsartan, per le iniezioni replicate non è superiore al 5%.
Procedura-Iniettare separatamente volumi uguali (circa 10 µL) della soluzione standard e della soluzione test nel cromatografo, registrare i cromatogrammi e misurare le aree dei picchi principali. Calcolare la percentuale di composto A correlato al valsartan nella porzione di Valsartan presa dalla formula:
100(CS / CU)(rU / rS)
in cui CS è la concentrazione, in mg per mL, del composto A RS correlato al valsartan USP nella soluzione standard; CU è la concentrazione, in mg per mL, di valsartan nella soluzione Test; e rU e rS sono le risposte di picco per il composto A correlato a valsartan ottenute rispettivamente dalla soluzione test e dalla soluzione standard: non si trova più dell'1,0%.
test 2 (limite del composto b correlato a valsartan, composto c correlato a valsartan e altri composti correlati)-
Fase mobile-Procedere come indicato nel dosaggio.
Soluzione standard - Sciogliere quantità accuratamente pesate di USP Valsartan RS, USP Valsartan Related Compound B RS e USP Valsartan Related Compound C RS nella fase mobile e diluire quantitativamente, e gradualmente se necessario, con la fase mobile per ottenere una soluzione avente concentrazioni note di circa 0,001 mg di valsartan per ml, 0,001 mg di composto B correlato a valsartan per ml e 0,001 mg di composto correlato a valsartan composto C per ml.
Soluzione test-Trasferire circa 50 mg di Valsartan, accuratamente pesati, in un matraccio tarato da 100-mL, sciogliervi e diluire con la fase mobile a volume e mescolare.
Sistema cromatografico (vedi Cromatografia<621>)-Preparare come indicato nel dosaggio, tranne per l'uso di un rilevatore da 225-nm. Cromatografare la soluzione standard e registrare le risposte dei picchi come indicato nella Procedura: la risoluzione, R, tra il composto B correlato a valsartan e valsartan non è inferiore a 1,8; la deviazione standard relativa, determinata dai picchi del composto B correlato a valsartan, per iniezioni ripetute non è superiore al 10,0%; e la deviazione standard relativa, determinata dai picchi di valsartan, per le iniezioni ripetute non è superiore al 2,0%.
Procedura-Iniettare separatamente volumi uguali (circa 10 µL) della soluzione standard e della soluzione test nel cromatografo, registrare i cromatogrammi e misurare le aree dei picchi principali. Calcolare la percentuale di composto B correlato a valsartan e di composto C correlato a valsartan nella porzione di Valsartan presa dalla formula:
100(CS / CU)(ri / rS)
in cui CS è la concentrazione, in mg per ml, dell'appropriato composto RS correlato al valsartan USP nella soluzione standard; CU è la concentrazione, in mg per mL, di valsartan nella soluzione Test; ri è la risposta di picco per l'impurezza ottenuta dalla soluzione Test; e rS è la risposta di picco per il composto correlato a valsartan appropriato ottenuto dalla soluzione standard. Calcolare la percentuale di ogni altra impurità nella porzione di Valsartan presa con la stessa formula, in cui CS è la concentrazione, in mg per mL, di USP Valsartan RS nella soluzione Standard; rS è la risposta di picco per valsartan ottenuta dalla soluzione Standard; e gli altri termini sono come definiti sopra: non si trova più dello 0,2% del composto B correlato a valsartan; non è stato trovato più dello 0,1% del composto C correlato a valsartan; non è stato trovato più dello 0,1% di qualsiasi altra impurezza individuale, escluso il composto A correlato a valsartan; e non si trova più dello 0,3% delle impurità totali, escluso il composto A correlato a valsartan.
Analisi-
Fase mobile-Preparare una miscela filtrata e degasata di acqua, acetonitrile e acido acetico glaciale (500:500:1). Se necessario, apportare le modifiche (vedere Idoneità del sistema in Cromatografia 621).
Preparazione standard - Sciogliere una quantità accuratamente pesata di USP Valsartan RS nella fase mobile e diluire quantitativamente, e gradualmente se necessario, con la fase mobile per ottenere una soluzione avente una concentrazione nota di circa 0,5 mg per mL.
Preparazione del test-Trasferire circa 50 mg di Valsartan, accuratamente pesati, in un matraccio tarato da 100-mL, sciogliervi e diluire con la fase mobile a volume e mescolare.
Sistema cromatografico (vedi Cromatografia<621>)-Il cromatografo liquido è dotato di un rilevatore da 273-nm e di una colonna da 3,0-mm × 12,5-cm che contiene un impaccamento L1 da 5-μm. La portata è di circa 0,4 ml al minuto. Cromatografare la preparazione dello standard e registrare le risposte di picco come indicato nella procedura: la deviazione standard relativa per le iniezioni replicate non è superiore al 2,0%.
Procedura-Iniettare separatamente volumi uguali (circa 10 µL) della preparazione dello standard e della preparazione del test nel cromatografo, registrare i cromatogrammi e misurare le aree dei picchi principali. Calcolare la quantità, in mg, di C24H29N5O3 nella porzione di Valsartan assunta con la formula:
100°C(rU/rS)
in cui C è la concentrazione, in mg per mL, di USP Valsartan RS nella preparazione Standard; e rU e rS sono le risposte di picco ottenute rispettivamente dalla preparazione del test e dalla preparazione dello standard.
Pacchetto: Bottiglia, sacchetto di alluminio, tamburo di cartone da 25 kg o secondo le esigenze del cliente.
Condizioni di conservazione: Tenere il contenitore ben chiuso e conservarlo in un magazzino fresco, asciutto (2~8℃) e ben ventilato, lontano da sostanze incompatibili. Proteggere dalla luce e dall'umidità.
Spedizione: Consegna in tutto il mondo via aerea, tramite FedEx / DHL Express. Fornire consegne rapide e affidabili.

Simboli di pericolo Xi - Irritante
Codici di rischio
36/37/38- Irritante per gli occhi, le vie respiratorie e la pelle.
Descrizione di sicurezza
S26 - In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico.
S37/39 - Indossare guanti adatti e proteggersi gli occhi/il viso
WGK Germania 3
RTECS YV9455000
Codice HS 2933990099
Shanghai Ruifu Chemical Co., Ltd. è il principale produttore e fornitore di Valsartan (CAS: 137862-53-4) di alta qualità. Valsartan è un antagonista non peptidico del recettore AT1 dell'angiotensina II, antipertensivo, potenzialmente utile per la ricerca sull'ipertensione arteriosa e sull'insufficienza cardiaca.
Gli effetti antipertensivi del valsartan sono più forti di quelli dell’enalapril ed è adatto per il trattamento dell’ipertensione, dell’ipertensione primaria da lieve a moderata e soprattutto dell’ipertensione secondaria causata da danno renale. Può ridurre significativamente la proteinuria nei pazienti ipertesi con diabete o con funzionalità epatica normale e può promuovere l'acido urico e il sodio urinario per proteggere i reni. Valsartan è adatto anche per ridurre la mortalità cardiovascolare nei pazienti ad alto rischio (insufficienza o disfunzione ventricolare sinistra) dopo aver subito un infarto.